

Nächste Seite: Proteine
Aufwärts: Die Atombindung
Vorherige Seite: Der räumliche Aufbau von
Inhalt
Mesomerie
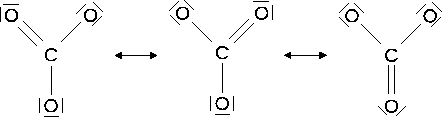
Viele Moleküle lassen sich durch eine Lewis-Formel nur unzureichend beschreiben. So kann man das CO3-Ion auf drei verschiedene Arten darstellen.
Abbildung 2.6:
Grenzstrukturen des CO3-Ions
|
|
Die einzelnen Lewis-Formeln in Abbildung 2.6 werden auch Grenzstrukturen genannt. Sie stellen nur einen begrenzten Teil der Realität dar. In jeder Grenzstruktur bildet das Kohlenstoffatom zwei Einfachbindungen und eine Doppelbindung zu den jeweiligen Sauerstoffatomen. Zu welchem Sauerstoffatom die Doppelbindung gebildet wird, ist jedoch unklar. Welche Struktur ist aber nun die Richtige?
Der reale Zustand wird durch keine der drei Formeln beschrieben, denn alle Bindungen sind gleich lang. Sie sind stabiler und länger als eine Doppelbindung und kürzer als eine Einfachbindung. Auch die elektrische Ladung der Sauerstoffatome ist gleich. Am ehesten läßt sich der Zustand als Mittel aller Grenzstrukturen auffassen. Da das Elektronenpaar nicht einer Bindung zuzuordnen ist, spricht man von einer Delokalisierung der Elektronen, wodurch ebenfalls die Struktur nicht eindeutig dargestellt werden kann. Diesen Zustand bezeichnet man als Mesomerie.
Oliver Krone
2003-04-28